MONTRÉAL, le 15 juin 2022 – Tout le monde sait que le cerveau humain est extrêmement complexe. Mais comment apprend-il exactement? Eh bien, la réponse pourrait être beaucoup plus simple qu'on le croit.
Une équipe de recherche internationale dont fait partie Eilif Muller, chercheur au Centre de recherche du CHU Sainte-Justine a réalisé une avancée majeure en simulant avec précision les changements synaptiques dans le néocortex qui sont considérés comme essentiels à l’apprentissage, ouvrant ainsi la voie à une meilleure compréhension du fonctionnement du cerveau.
L’étude — qui s’appuie sur un modèle à code source ouvert — a été publiée le 1er juin dans la revue scientifique Nature Communications.
Un monde de nouvelles orientations
« Cela ouvre un monde de nouvelles avenues pour investiguer et mieux comprendre la façon dont nous apprenons », a déclaré Eilif Muller, qui est également professeur adjoint au Département de neurosciences de l’Université de Montréal (UdeM), chercheur à IVADO — l’Institut de valorisation des données — titulaire d’une chaire ICRA-Canada en intelligence artificielle (IA) et qui a codirigé l’étude au Blue Brain Project de l’École polytechnique fédérale de Lausanne (EPFL), en Suisse.
Eilif Muller a déménagé à Montréal en 2019 et poursuit ses recherches au laboratoire Architectures of Biological Learning, qu’il a fondé au Centre de recherche du CHU Sainte-Justine en association avec l’UdeM et Mila, l’Institut québécois d’intelligence artificielle.
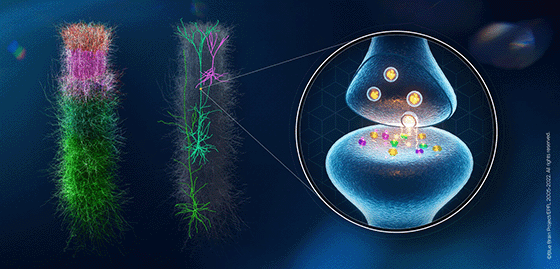
« Les neurones ont la forme d’un arbre et les synapses sont les feuilles sur les branches, a expliqué le professeur Muller, coauteur principal de l’étude. Les approches antérieures pour modéliser la plasticité ont ignoré cette structure arborescente, mais maintenant nous avons les outils informatiques pour tester l’idée que les interactions synaptiques sur les branches jouent un rôle fondamental dans le guidage de l’apprentissage in vivo. »
Selon lui, « cela a des implications importantes pour la compréhension des mécanismes des troubles neurodéveloppementaux tels que l’autisme et la schizophrénie, mais aussi pour la mise au point de nouvelles approches puissantes de l’IA inspirées des neurosciences ».
Des collaborateurs dans cinq pays
Eilif Muller a collaboré avec un groupe de scientifiques du Blue Brain Project de l’EPFL, de l’Université de Paris, de l’Université hébraïque de Jérusalem, de l’Instituto Cajal (Espagne) et de la Harvard Medical School pour élaborer un modèle de plasticité synaptique dans le néocortex basé sur la dynamique du calcium postsynaptique sous contrainte de données.
Comment cela fonctionne-t-il? Plus simplement qu’on pourrait le penser.
Le cerveau est constitué de milliards de neurones qui communiquent entre eux en formant des trillions de synapses. Ces points de connexion entre neurones sont des machines moléculaires complexes qui changent constamment sous l’effet de stimulus externes et de dynamiques internes, un processus communément appelé plasticité synaptique.
Dans le néocortex, une zone clé du cerveau associée à l’apprentissage des fonctions cognitives de haut niveau chez les mammifères, les cellules pyramidales représentent de 80 à 90 % des neurones et sont connues pour jouer un rôle majeur dans l’apprentissage. Malgré leur importance, la dynamique à long terme de leurs changements synaptiques n’a été caractérisée expérimentalement qu’entre quelques-uns de leurs types et elle s’est avérée diverse.
Une compréhension limitée
Par conséquent, la compréhension des circuits neuronaux complexes formés, en particulier à travers les couches corticales stéréotypées, qui dictent la façon dont les diverses régions du néocortex interagissent, est limitée. L’innovation d’Eilif Muller et de ses collègues a consisté à utiliser la modélisation informatique pour obtenir une vision plus complète de la dynamique de la plasticité synaptique qui régit l’apprentissage dans ces circuits néocorticaux.
En comparant leurs résultats avec les données expérimentales disponibles, ils ont montré dans leur étude que leur modèle de plasticité synaptique peut rendre compte des dynamiques de plasticité variées des diverses cellules pyramidales qui composent le microcircuit néocortical. Ils y sont parvenus en recourant à un seul ensemble unifié de paramètres du modèle, ce qui indique que les règles de plasticité du néocortex pourraient être partagées par tous les types de cellules pyramidales et donc être prévisibles.
La plupart de ces expériences de plasticité ont été réalisées sur des tranches de cerveau de rongeurs in vitro, où la dynamique calcique qui régit la transmission synaptique et la plasticité est considérablement modifiée par rapport à l’apprentissage dans le cerveau intact in vivo. Fait important, l’étude prédit une dynamique de plasticité qualitativement différente des expériences de référence réalisées in vitro.
Si cela est confirmé par de futures expériences, les implications pour notre compréhension de la plasticité et de l’apprentissage dans le cerveau seraient majeures, estiment Eilif Muller et son équipe.
« Ce qui est passionnant dans cette étude, c’est qu’il s’agit d’une confirmation supplémentaire pour les scientifiques que nous pouvons surmonter les lacunes des connaissances expérimentales en utilisant une approche de modélisation quand on étudie le cerveau », a mentionné le neuroscientifique de l’EPFL Henry Markram, fondateur et directeur du Blue Brain Project.
C’est de la science ouverte
« De plus, le modèle est à code source ouvert, disponible sur la plateforme Zenedo, a-t-il ajouté. Ici, nous avons partagé des centaines de connexions plastiques de cellules pyramidales de différents types. Non seulement il s’agit du modèle de plasticité le plus largement validé à ce jour, mais il représente également la prédiction la plus complète des différences entre la plasticité observée dans une boîte de Petri et dans un cerveau intact. »
Henry Markram a conclu en disant que « ce bond en avant est rendu possible grâce à notre approche scientifique collaborative en équipe. En outre, la communauté peut aller plus loin et concevoir ses propres versions en les modifiant ou en les complétant. C’est de la science ouverte et cela accélérera le progrès ».
– 30 –
À propos de l’étude
L’étude intitulée « A calcium-based plasticity model for predicting long-term potentiation and depression in the neocortex », par Giuseppe Chindemi et ses collaborateurs, a été publiée le 1er juin 2022 dans Nature Communications. Le financement du Blue Brain Project a été assuré par le Conseil des écoles polytechniques fédérales. Le travail d’Eilif Muller a également été financé par le Centre de recherche du CHU Sainte-Justine, la Fondation CHU Sainte-Justine, IVADO — l’Institut de valorisation des données —, le Fonds de recherche du Québec – Santé, le programme de chaires en IA Canada-CIFAR, Mila – l’Institut québécois d’intelligence artificielle – et Google.
À PROPOS DU CENTRE DE RECHERCHE DU CHU SAINTE-JUSTINE
Le Centre de recherche du CHU Sainte-Justine est un établissement phare en recherche mère-enfant affilié à l’Université de Montréal. Axé sur la découverte de moyens de prévention innovants, de traitements moins intrusifs et plus rapides et d’avenues prometteuses de médecine personnalisée, il réunit plus de 210 chercheurs, dont plus de 110 chercheurs cliniciens, ainsi que 450 étudiants de cycles supérieurs et postdoctorants. Le centre est partie intégrante du Centre hospitalier universitaire Sainte-Justine, le plus grand centre mère-enfant au Canada.
recherche.chusj.org
@CR_CHUSJ